新聞中心
News Center
為癌癥胸腹水患者帶來福音 中國生物制藥腫瘤創新藥再添新成員
發布時間:2024-10-08
惡性胸腹水是晚期腫瘤患者常見的并發癥之一,一旦癌癥晚期合并胸腹水,患者生存期就會迅速縮短至幾個月甚至幾周,并嚴重影響患者的生活質量。不過,針對惡性胸腹水的國產創新藥有望加速面世。10月8日,中國生物制藥(1177.HK)發布公告,附屬公司正大天晴藥業集團與武漢友芝友生物簽署獨家許可與合作協議,將通過引進友芝友生物研發的雙抗1類新藥M701,并推動該藥物盡快上市,造福廣大惡性胸腹水患者。
通過本次合作,正大天晴將獲得M701在中國大陸地區的開發、注冊、生產和商業化的獨家、可分許可的許可。M701目前處于臨床III期,擬被開發用于腫瘤引起的惡性胸水(MPE)和惡性腹水(MA)的治療,是國內首個自主開發并進入臨床試驗階段的CD3/EpCAM雙特異性抗體。
正大天晴將根據研發進展情況,就許可產品向友芝友生物支付約3.15億元的首付款及研發里程碑款項,并支付最高不超過7億元的銷售里程碑款項,同時按年凈銷售額的個位數至低雙位數百分比向友芝友生物支付分層特權使用費。
“腹水抽了又漲、漲了再抽”是許多癌癥患者在晚期、終末期會經歷的癥狀,最常見于卵巢癌和消化道腫瘤,包括結腸癌、胃癌、胰腺癌等。胸腹水發病原因復雜,病因與原發腫瘤的來源一般相獨立,因此癌癥患者一旦出現胸腹水,不僅嚴重影響生活質量,而且預后也將迅速變差。弗若斯特沙利文數據顯示,中國每年預計有超過60萬名新發惡性胸腹水患者,超10%的癌癥患者在臨床病程中會出現惡性胸腹水[1][2]。
惡性胸腹水的治療一直是個棘手問題,目前臨床仍以穿刺引流聯合局部胸腹腔灌注藥物為主,局部治療藥物選擇有限,缺乏有效的標準治療方案,存在巨大的未滿足需求。M701有望成為胸腹水治療的標準方案。
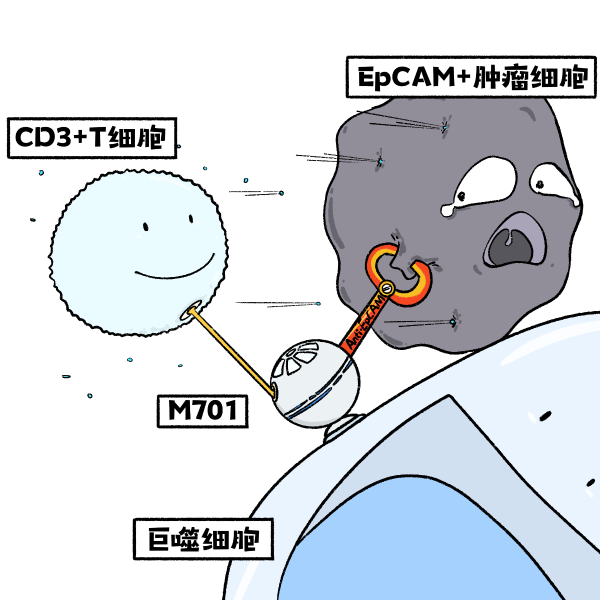
相比常規的單靶點抗體藥物只能用于抑制某一個或一類靶點,作為雙特異性抗體(簡稱“雙抗”)藥物,能夠同時抑制兩個或兩類靶點。M701可以同時靶向腫瘤細胞靶點EpCAM和免疫T細胞活化靶點CD3,通過雙靶結合橋連腫瘤細胞和免疫T細胞,從而啟動T細胞對腫瘤細胞進行殺傷,因此腹腔/胸腔灌注M701可啟動免疫細胞靶向清除和抑制腹腔/胸腔中的腫瘤細胞[3]。
2024年2月,M701獲得國家藥監局藥品審評中心(CDE)批準在中國開展單藥用于MA的Ⅲ期注冊臨床,同時正在開展針對非小細胞肺癌引起的MPE的Ⅱ期臨床試驗。
今年6月,M701在美國臨床腫瘤學會年會(2024 ASCO)上公布了用于治療MA的II期臨床試驗的中期分析數據[4]。今年9月,M701在歐洲腫瘤內科學會年會(2024 ESMO)上公布了其用于MPE治療的早期臨床數據,展示出良好的胸水控制表現[5]。

腫瘤是中國生物制藥四大重點治療領域之一。今年上半年,公司已有3款腫瘤領域1類創新藥獲批上市,同期國內第一。此次引進M701,將進一步完善公司在腫瘤領域的布局。中國生物制藥預計M701的銷售峰值將突破20億元,有望成為公司腫瘤領域下一個重磅產品。
參考文獻:
[1] 弗若斯特沙利文
[2] Liao R, Yang X, Wang S, Zhou Q, Nie Q, Zhong W, Dong S, Wu Y. [Clinical role of F-18 FDG PET/CT in differentiating malignant and benign pleural effusion in patients with lung cancer]. Zhongguo Fei Ai Za Zhi. 2012 Nov;15(11):652-5.
[3]Li YN, Li YY, Wang SX, Ma XY,Efficacy of Bispecific Antibody Targeting EpCAM and CD3 for Immunotherapy in Ovarian Cancer Ascites: An Experimental Study, Current Medical Science. 2021 Apr 4,43(3):539-550.
[4]Rongbo Lin,An anti-EpCAM x anti-CD3 bispecific antibody, M701, for the treatment of malignant ascites due to epithelial cancer: Interim results of a prospective randomized controlled phase II trial,online,ASCO 2024.
[5]Jun Cai ,An anti-EpCAM x CD3 bispecific antibody, M701, for the treatment of malignant pleural effusion in NSCLC patients: Intermediate results of a prospective multicenter phase Ib trial,poster,ESMO 2024.
▲ 上下滑動查看更多
聲明:
1.本新聞稿旨在促進醫藥信息的溝通和交流,僅供醫療衛生專業人士參閱,非廣告用途。
2.本公司不對任何藥品和/或適應癥作推薦。
3.本新聞稿中涉及的信息僅供參考,不能以任何方式取代專業的醫療指導,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,包括有關【M701(CD3/EpCAM雙特異性抗體)】的臨床開發計劃、臨床獲益與優勢的預期、商業化展望、患者臨床獲益可能性,以及潛在商業機會等聲明。“預期”、“相信”、“繼續”、“可能”、“估計”、“期望”、“有望”、“打算”、“計劃”、“潛在”、“預測”、“預計”、“應該”、“將”、“擬”、“會”和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述為公司基于當前所掌握的數據和信息所做的預測或期望,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不可完全依賴本新聞稿中的前瞻性陳述,該等陳述包含信息僅及于本新聞稿發布當日。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。
內容來源:中國生物制藥有限公司于香港聯交所發布的公告