新聞中心
News Center
中國生物制藥1類新藥BCL-2抑制劑獲批臨床
發布時間:2024-10-29
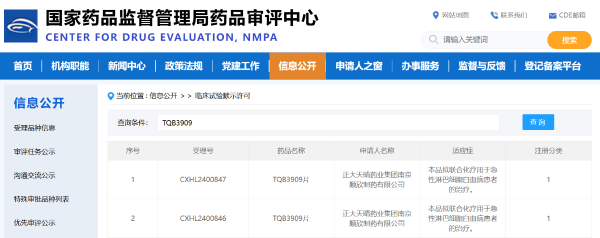
10月29日,中國生物制藥1類新藥BCL-2抑制劑——TQB3909片獲得國家藥監局藥品審評中心(CDE)臨床試驗批準,擬聯合化療用于急性淋巴細胞白血病(ALL)患者的治療。9月中旬舉辦的2024年歐洲腫瘤內科學會(ESMO)年會上,中國生物制藥以口頭報告的形式首次公布了TQB3909治療復發或難治性非霍奇金淋巴瘤(NHL)和急性白血病(AML)的I期臨床研究結果。
BCL-2家族蛋白可以通過阻止線粒體外膜通透化(MOMP)從而抑制腫瘤細胞凋亡,其過表達與癌癥的耐藥性的形成密切相關。通過抑制BCL-2與促凋亡蛋白(如BAK)的結合,抑制BCL-2依賴性腫瘤的生長,從而發揮抗腫瘤的作用。
TQB3909是中國生物制藥自主研發的一款BCL-2抑制劑。中國生物制藥在2024 ESMO公布的一項I期臨床研究共納入69例患者接受TQB3909治療,其中34例復發或難治性非霍奇金淋巴瘤(R/R NHL)、18例慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(R/R CLL/SLL),以及17例急性白血病(AML)。
研究數據表明,TQB3909治療R/R CLL/SLL患者總體緩解率(ORR)為88.9%,完全緩解/完全緩解伴不完全血液學恢復(CR/CRi)為44.4%;對BTK抑制劑耐藥的R/R CLL/SLL患者的ORR為83.3%,CR/CRi為41.7%[1]。
目前,TQB3909還有一項探索其在復發或難治性套細胞淋巴瘤(MCL)患者中的安全性及有效性的Ib/II期臨床試驗正在開展。隨著TQB3909又一個臨床申請獲批準,中國生物制藥在抗癌藥物研發領域再次邁出了堅實的一步。
參考文獻:
[1]Junyuan Qi.First report of BCL-2 inhibitor TQB3909 in pts with relapsed or refractory non-Hodgkinlymphoma (NHL) and acute myeloid leukemia (AML): Data from a phase I study.ESMO 2024.800MO
聲明:
1. 本新聞稿旨在促進醫藥信息的溝通和交流,僅供醫療衛生專業人士參閱,非廣告用途。
2. 本公司不對任何藥品和/或適應癥作推薦。
3. 本新聞稿中涉及的信息僅供參考,不能以任何方式取代專業的醫療指導,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,包括有關【TQB3909片】的臨床開發計劃、臨床獲益與優勢的預期、商業化展望、患者臨床獲益可能性,以及潛在商業機會等聲明。“預期”、“相信”、“繼續”、“可能”、“估計”、“期望”、“有望”、“打算”、“計劃”、“潛在”、“預測”、“預計”、“應該”、“將”、“擬”、“會”和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述為公司基于當前所掌握的數據和信息所做的預測或期望,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不可完全依賴本新聞稿中的前瞻性陳述,該等陳述包含信息僅及于本新聞稿發布當日。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。